Онкология
Несмотря на безусловные достижения современной противоопухолевой химио- и лучевой терапии, проблема повышения эффективности лечения онкологических больных по-прежнему остается крайне актуальной. Результаты основной терапии могут быть улучшены лекарственными средствами, которые 1 2 3 4 :
- относительно избирательно воздействуют на свойства опухолевых клеток (таргетная терапия);
- снижают токсичность цитостатиков и(или) защищают от их действия нормоциты;
- подавляют лекарственную устойчивость;
- стимулируют эритро-, лейкопоэз;
- другими средствами комплексной терапии злокачественных опухолей.
Одним из препаратов выбора в решении многих проблемных аспектов химио-, лучевой и химиолучевой терапии является средство комплексного действия, российский инновационный препарат Глутоксим®.
Применение препарата Глутоксим® в комплексном лечении онкологических больных приводит к:
- улучшению переносимости химио-, лучевой и химиолучевой терапии;
- потенцированию терапевтического действия средств химиотерапии;
- потенцированию терапевтического действия лучевой/химиолучевой терапии;
- избирательному ингибированию лекарственной устойчивости опухолевых клеток;
- увеличению продолжительности ремиссии болезни и продолжительности жизни пациентов;
- повышению качества жизни пациентов как во время лечения, так и при последующем наблюдении.
Какие же клинические эффекты присущи препарату Глутоксим®?
Глутоксим улучшает переносимость химио-, лучевой и химиолучевой терапии
Глутоксим® позволяет уменьшить частоту развития лейкопении и тромбоцитопении при проведении химиотерапии либо сместить глубокую токсичность в область умеренной, а также способствует более быстрому восстановлению содержания лейкоцитов, тромбоцитов и эритроцитов в периферической крови при химио- и лучевой терапии5 6 7.
В исследовании отделения химиотерапии НИИ клинической онкологии РОНЦ им.Н.Н.Блохина (руководитель – доктор медицинских наук профессор В.А.Горбунова) применение препарата Глутоксим® при проведении химиотерапии по схеме [этопозид + цисплатин] у больных с морфологически подтвержденным немелкоклеточным раком легкого IIIб-IV стадии, не получавших ранее химио- и лучевой терапии, позволило снизить частоту развития глубокой нейтропении (3 и 4 степени токсичности по ВОЗ) в 2,5 раза (р = 0,002). На фоне применения препарата Глутоксим® наблюдалось смещение глубокой токсичности в область умеренной8.
Через неделю после начала химиотерапии на фоне применения препарата Глутоксим® отмечается достоверно более высокое, чем в контрольной группе, содержание нейтрофилов в периферической крови (p=0,008)9.
К концу 2-ой недели у всех больных раком шейки матки III стадии, получающих лучевую терапию по радикальной методике, отмечается синхронное уменьшение количества лейкоцитов и лимфоцитов в периферической крови, а также уровня гемоглобина, что сопровождается нарастанием субъективных жалоб на головную боль, слабость, недомогание, снижение аппетита.
В дальнейшем наблюдается улучшение названных показателей крови и их последующее увеличение к концу курса облучения, достоверно большее при включении в терапию препарата Глутоксим® .
У пациенток раком шейки матки III стадии, получающих лучевую терапию по расщепленной методике, которым во время запланированного перерыва в лечении вводили Глутоксим®, при поступлении на II этап ЛТ уровень гемоглобина, количество лейкоцитов и лимфоцитов достоверно выше, чем в контроле (р<0,05). К концу курса облучения в обеих группах отмечена общая тенденция к улучшению этих показателей, однако у получавших Глутоксим® количество лимфоцитов было существенно выше, чем в контроле (p<0, 05).
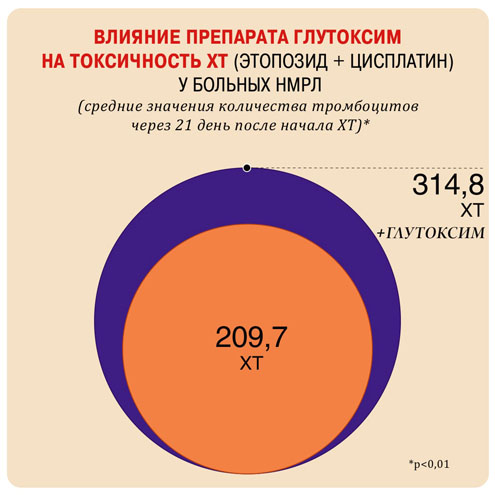
Применение препарата Глутоксим® при проведении химиотерапии по схеме [этопозид + цисплатин] у больных с немелкоклеточным раком легкого IIIб-IV стадии, не получавших ранее химио- и лучевой терапии, позволяет уменьшить частоту развития общей тромбоцитопении в 1,6 раза: она наблюдается у 22% пациентов, а в случаях, когда Глутоксим® не назначается – у 36% (р = 0,04)10.
На 21-й день после химиотерапии в группе, получавшей, наряду с ХТ, Глутоксим®, отмечается статистически значимое (в 1,5 раза) увеличение числа тромбоцитов (p=0,01)11.
При изучении частоты развития различных степеней не только тромбоцитопении, но и анемии, также отмечалась тенденция к смещению глубокой токсичности в область умеренной12.
При проведении ХТ с включением препарата Глутоксим® у больных с резистентным к препаратам платины раком яичников с 1-3 предшествующими линиями терапии наблюдалась токсичность легкой или средней степени тяжести без проявлений токсичности 4 степени. Признаков фебрильной нейтропении не было. Наиболее частыми проявлениями токсичности были тошнота и утомляемость, а также боли в животе и непроходимость кишечника, которые, как считается, связаны с течением основного заболевания. Наблюдались умеренные проявления гематологической токсичности13.
При применении препарата Глутоксим® у пациентов с раком орофарингеальной области III-IV стадии гемодепрессия на фоне лучевой терапии достоверно менее выражена14.
NB! Прочитайте историю пациентки с раком яичников, которая наблюдается в отделении химиотерапии Онкологического центра ЦКБ №2 им. Н.А.Семашко (Москва)
NB!Прочитайте интервью с врачом-химиотерапевтом Светланой Уваровой
NB! Прочитайте историю пациентки с раком шейки матки (наблюдение II радиологического отделения Городского клинического онкологического диспансера Санкт-Петербурга
NB! Прочитайте историю пациентки с раком анального отдела (наблюдение II радиологического отделения Городского клинического онкологического диспансера Санкт-Петербурга
Глутоксим® уменьшает частоту развития и степень выраженности проявлений других видов токсичности ХТ: гепато-, нефро-15, нейротоксичности. Глутоксим® способствует предупреждению или уменьшению выраженности тошноты/рвоты, диспепсии.
NB! Прочитайте историю пациентки с раком яичников, которая наблюдается в отделении химиотерапии Онкологического центра ЦКБ №2 им. Н.А.Семашко (Москва)
NB! Прочитайте интервью с врачом-химиотерапевтом Светланой Уваровой
NB! Прочитайте историю пациентки с раком анального отдела (наблюдение II радиологического отделения Городского клинического онкологического диспансера Санкт-Петербурга
Глутоксим® способствует предупреждению или уменьшению выраженности реакций кожи (дерматитов)16 и слизистых (мукозитов, стоматитов, ректитов, цервицитов) на облучение и воздействие химиопрепаратов.
Осложнения в виде ранних лучевых ректитов у получавших радикальный курс больных раком шейки матки III стадии на фоне применения препарата Глутоксим®, возникали достоверно реже (р<0,05), чем в контроле17. Восстановление функций тазовых органов у больных, получавших Глутоксим®, происходило быстрее.
Применение препарата Глутоксим® способствует значительному снижению выраженности субъективных проявлений радиоэпителиита. Наиболее существенно это проявлялось в отношении таких симптомов, как боль при глотании, изменение вкуса18.
При применении препарата Глутоксим® существенно снижались частота появления кровоточивости десен, возникновения очагового эпителиита. Эрозии, язвы, некрозы и сливной эпителиит не возникли ни у одного из пациентов с раком орофарингеальной области III-IV стадии, получавших Глутоксим®19.
NB! Прочитайте историю пациентки с раком анального отдела (наблюдение II радиологического отделения Городского клинического онкологического диспансера Санкт-Петербурга
Глутоксим® способствует проведению химио-, лучевой и химиолучевой терапии в полном объёме, без редукции запланированных курсов и доз химиопрепаратов/облучения.
В исследовании отделения химиотерапии НИИ клинической онкологии РОНЦ им.Н.Н.Блохина (руководитель – доктор медицинских наук профессор В.А.Горбунова) при проведении химиотерапии по схеме [этопозид + цисплатин] у больных с морфологически подтвержденным немелкоклеточным раком легкого IIIб-IV стадии, не получавших ранее химио- и лучевой терапии, без применения препарата Глутоксим® отсрочка лечения была произведена у 3-х больных (12,5%) при проведении 6-ти курсов (7,1%) химиотерапии. Среди получавших Глутоксим®, отсрочка лечения отмечалась только у одного пациента (3,3%) в одном курсе ХТ (0,8%). Авторы сообщают, что применение препарата позволило провести повторные курсы химиотерапии строго в срок, без отсрочек по причине гематологической токсичности20.
Несмотря на интенсивный режим ХЛТ, в группе больных раком шейки матки III стадии, получавшей Глутоксим®, отказаться от продолжения введения химиопрепаратов пришлось только у 1 пациентки из 35 (2,9%). Дозы – не редуцировались. В контрольной группе в связи с ухудшением состояния (увеличением активности АЛТ, содержания креатинина в сыворотке крови и лейкопенией) отказаться от продолжения введения цисплатина пришлось у 2 пациенток из 20 (10%), редуцировать дозы – 4 пациенткам (20%)21.
NB! Прочитайте историю пациентки с раком яичников, которая наблюдается в отделении химиотерапии Онкологического центра ЦКБ №2 им. Н.А.Семашко (Москва)
NB! Прочитайте интервью с врачом-химиотерапевтом Светланой Уваровой
Глутоксим® улучшает качество жизни больных, способствует сохранению социальной и физической активности пациентов при проведении химио- и лучевой терапии.
При достижении СОД облучения 40 Гр, а также к концу лучевой терапии и достижении СОД 60 Гр, Глутоксим® способствовал восстановлению качества жизни пациентов с раком орофарингеальной области III-IV стадии. При этом индекс Карновского возрастал до 90% (при 50-60% в контроле)22.
«Тот факт, что показатели периферической крови в группе пациентов, получавших Глутоксим®, были достоверно выше, чем в контрольной (р < 0,05) на протяжении всей второй половины радикального курса лучевой терапии, несомненно способствовал улучшению общего состояния пациенток. Индекс Карновского, составлявший у всех пациенток до лечения 30-50%, у получавших Глутоксим® возрос до 90-100%, тогда как в контроле не поднимался выше 90%23».
NB! Прочитайте историю пациентки с раком яичников, которая наблюдается в отделении химиотерапии Онкологического центра ЦКБ №2 им. Н.А.Семашко (Москва)
NB! Прочитайте интервью с врачом-химиотерапевтом Светланой Уваровой
NB! Прочитайте историю пациентки с раком анального отдела (наблюдение II радиологического отделения Городского клинического онкологического диспансера Санкт-Петербурга
Глутоксим: фармакологические основы улучшения переносимости химио-, лучевой и химиолучевой терапии
Действие препарата Глутоксим® приводило к нормализации детоксикационных возможностей гепатоцитов посредством стимуляции систем активного транспорта апикальной и базолатеральной мембран, цитозольных ферментов нейтрализации ксенобиотиков, включая гемооксигеназу-1, глутатион-S-трансферазу, глутатионредуктазу, Г6ФДГ и др.24

Глутоксим® повышает способность нормоцитов адаптироваться к стрессорным воздействиям различной природы:
1.На примере клеток эпителия слизистых доказана способность препарата увеличивать их выживаемость и репаративную активность при лучевом воздействии. Глутоксим® инициировал комплекс молекулярных защитных и репаративных реакций посредством активации и трансактивации рецепторных тирозинкиназ, сигналпередающих белков25 26 27 системы редокс-контроля клеточных функций. Действие препарата способствовало эффектвной регенерации и восстановлению целостности эпителия кожи и слизистых при лучевом воздействии, проведении химиолучевой терапии28 29 30.
2.На примере клеток костного мозга показана способность препарата Глутоксим® стимулировать активность клеток кроветворной ткани при лучевом поражении31, Препарат восстанавливал физиологически адекватный уровень лейко- и эритропоэза, тромбоцитопоэза посредством сенсибилизации рецепторов стволовых клеток к колониестимулирующим факторам32.
Глутоксим способствует улучшению результатов химио-, лучевой и химиолучевой терапии
При включении в сочетанную лучевую терапию больных раком шейки матки III стадии (радикальный курс) препарата Глутоксим® полная ремиссия отмечена у 77% больных при 38% в контрольной группе 35 .
При включении в сочетанную лучевую терапию больных раком шейки матки III стадии (расщепленная методика) препарата Глутоксим® наблюдается существенный рост количества больных с полной ремиссией 36 .
Частота положительных ответов на лучевую терапию у больных раком орофарингеальной области III - IVстадии (полная + частичная ремиссия) в группе больных, получавших Глутоксим®, была существенно выше (р < 0,05), чем в контрольной группе (83, 4% и 61,5% соответственно) 37 .
Препараты платины остаются единственными наиболее эффективными препаратами для лечения эпителиального рака яичников. Однако, в случае рецидива и при повторном лечении у большинства больных развивается резистентность к этим средствам. Показатель ответа на ХТ в этой группе пациентов составляет 10-20%, при этом обычно безрецидивная выживаемость составляет < 8 недель для 4-й линии терапии.
При ХТ больных резистентным к препаратам платины раком яичников с включением препарата Глутоксим® (NOV-002) медиана безрецидивной выживаемости составила 15,4 нед., что дольше при сравнении с данными исторического контроля, равными приблизительно 8 нед. 38 у пациентов с таким же по интенсивности лечением 39 . Средний период безрецидивной выживаемости составил 19,4 нед., что указывает на наличие пролонгированного благоприятного клинического эффекта у некоторых пациентов. Включение препарата Глутоксим® (NOV-002) в схему ХТ показало клиническую целесообразность (полная ремиссия+частичная ремиссия+стабилизация) у 60% пациентов.
Известно, что низкая остаточная опухолевая нагрузка после неоадьювантной терапии ассоциируется с лучшей безрецидивной выживаемостью больных раком молочной железы. Достижение полной морфологической ремиссии (регрессии) опухоли при проведении неоадьювантной терапии наиболее достоверно коррелирует с ростом общей выживаемости.
У больных HER-2(-) раком молочной железы II – III стадии присоединение к неоадьювантной терапии препарата Глутоксим® привело к удвоению достигавшейся ранее частоты полной морфологической ремиссии 40 .
Глутоксим: фармакологические основы улучшения результатов химио-, лучевой и химиолучевой терапии
Препарат ингибирует выброс противоопухолевого препарата из клетки-мишени, подавляя функциональную активность мембранного транспортного белка Р-гликопротеина и, тем самым, потенцирует действие цитостатика за счет увеличения его концентрации в фармакологической мишени 41 .
Продемонстрировано увеличение внутриклеточного накопления доксорубицина в клетках Т-лимфобластного лейкоза человека линии Jurkat после преинкубации клеток с препаратом Глутоксим® (за единицу принята концентрация 5 х10-7М) 42 .
Улучшая переносимость химиотерапии и лучевой терапии за счет уменьшения частоты развития и степени выраженности токсичности терапии (подробнее), Глутоксим® также способствует проведению химиотерапии в полном объёме.
Схема применения
Далее на протяжении 21 дня между курсами химиотерапии Глутоксим® 30мг/мл (3%), 2мл (60мг) вводится подкожно на 2, 4, 6, 8, 10, 12, 14, 16, 18 и 20 дни. При следующем курсе химиотерапии (через 21 день) схема введения препарата повторяется.
При лучевой терапии опухолей различной локализации Глутоксим® 30мг/мл (3%), 2мл (60мг) вводится подкожно через 0,5-1 час после очередного сеанса радикального облучения, далее на протяжении 6-7 недель лучевой терапии на 1, 3 и 5 дни каждой недели.
При лучевой терапии по расщепленной методике Глутоксим® 30мг/мл (3%), 2мл (60мг) вводится подкожно на 1, 3 и 5 дни каждой недели в течение перерыва между сеансами лучевой терапии.
Глутоксим® назначается онкологическим больным только при проведении курсов химио- и лучевой терапии. Исключение составляет применение препарата у пациентов, страдающих злокачественными новообразованиями в IV стадии с целью улучшения качества жизни.
Формы выпуска: 30мг/мл (3%), 2мл (60мг в одной ампуле), по 5 или 10 ампул в упаковке.
Список литературы
- Антушевич А.Е., Ярцева А.А., Гребенюк А.Н. и соавт. Эффективность препарата моликсан в качестве средства профилактики и лечения химиолучевых стоматитов у онкологических больных. Материалы конференции «Токсикология и радиобиология XXI века», май 2017, с.233.
Скачать - Ярцева А.А. Патофизиологические основы применения дисульфидов глутатиона в качестве средств профилактики и лечения химиолучевых оральных мукозитов у больных раком орофарингеальной области. Автореферат дисс. … доктора мед.наук. Санкт-Петербург, 2015.
Скачать - Антушевич А.Е., Ярцева А.А., Гребенюк А.Н., Антонов В.А. Влияние моликсана на активность окислительно-восстановительных процессов в слизистой оболочке полости рта экспериментальных животных при комбинированном химиолучевом воздействии. Вестник Российской Военно-Медицинской Академии, 2014, 1(45),с. 152-155
Скачать - Ярцева А.А., Степанов А.В., Гребенюк А.Н. и соавт. Состояние микробиоценоза полости рта экспериментальных животных, подвергшихся комбинированному воздействию повреждающих факторов химиолучевой терапии. Вестник Российской Военно-Медицинской Академии, 2014, Т. 45, с. 105-109.
Скачать - Шемеровский А.К. Роль глутоксима в химиотерапевтическом и хирургическом лечении рака молочной железы. Автореф. … канд.мед.наук. Санкт-Петербург, 2013.
Скачать - Gumereddy К., Li A., Cao L. et al. NOV-002, а glutathione disulfide mimetic, suppresses tumor cell invasion and metastasis. J Carcinogene Mutagene, 2013.
Скачать - Gumereddy К., Li A., Cao L. et al. NOV-002, а glutathione disulfide mimetic, suppresses tumor cell invasion and metastasis. J Carcinogene Mutagene, 2013. Миметик глутатиона дисульфида подавляет инвазию опухолевых клеток и метастазирование. Перевод.
Скачать - Антушевич А.А., Антонов В.Г., Гребенюк А.Н. и соавт. Патофизиологические основы эффективности глутоксима как средства сопровождения лучевой терапии рака ротоглотки. Вестник Российской Военно- медицинской Академии, 2013, 3; 32 -37.
Скачать - Diaz-Montero C.M. et al. The glutatione disulfide mimetic NOV-002 inhibits cyclophosphamide-induced hematopoetic and immune supression by reducing oxidative stress. Free Radical Biology & Medicine 2012, 52, 1560-1568.
Скачать - Diaz-Montero C.M. et al. The glutatione disulfide mimetic NOV-002 inhibits cyclophosphamide-induced hematopoetic and immune supression by reducing oxidative stress. Free Radical Biology & Medicine 2012, 52, 1560-1568. Перевод.
Скачать - Манихас Г.М., Жукова Н.В. Применение препарата Глутоксим у больных раком желудка, получающих платиносодержащую химиотерапию. Онкология. Журнал им. П.А.Герцена, 2012, 1, 44-46.
Скачать - Montero A.J., Diaz-Montero C.M., Deutsch Y.E. et al. Phase 2 study of neoadjuvant treatment with NOV-002 in combination with doxorubicin and cyclophosphamide followed by docetaxel in patients with HER-2 negative clinical stage II-IIIc breast cancer. Breast Cancer Res Treat 2012, 132, 215-223.
Скачать - Montero A.J., Diaz-Montero C.M., Deutsch Y.E. et al. Phase 2 study of neoadjuvant treatment with NOV-002 in combination with doxorubicin and cyclophosphamide followed by docetaxel in patients with HER-2 negative clinical stage II-IIIc breast cancer. Breast Cancer Res Treat 2012, 132, 215-223. Перевод.
Скачать - Любарский М.С., Ткачук О.А., Нимаев В.В. и соавт. Профилактика инфекционных осложнений и лимфореи в послеоперационном периоде у больных после радикальной мастэктомии. Сибирский онкологический журнал, 2011, 3; 40-44.
Скачать - Филатова Е. И., Дятчина Е.В., Былинская Е.Н. и соавт. Оценка эффективности применения препарата Глутоксим при химиолучевом лечении больных местно- распространенным раком шейки матки. В сб.: Современное состояние диагностики, лечения и реабилитации в онкогинекологии. Санкт-Петербург, 2010; 145-147.
Скачать - Т. А. Богуш, Е. А. Дудко, Е. А. Богуш, В. Ю. Кирсанов, В. Г. Антонов. Глутоксим как ингибитор фенотипа множественной лекарственной резистентности, ассоциированной с экспрессией Pgp. Антибиотики и химиотерапия, 2010, 55, 5-6, с.18-23.
Скачать - A.J. Montero, C. M. Diaz-Montero, J. Slingerland, M. Pegram, J. Hurley, C.F. Welsh, E. Avisar, P. Seo, C.L. Voge, E. Garrett-Mayer, V. Hermann, M.K. Baker, O. Silva, L. Koniaris, S. Rodgers, K. Schuhwerk, C.J. Pazoles, D. J. Cole, S. Gluck. Phase 2 study of neoadjuvant treatment with cellular redox modulator NOV-002 in combination with doxorubicin and cyclophosphamide followed by docetaxel (ACT) in patients with stage II-III HER-2(-)breast cancer. Poster. 2010.
Скачать - Sara Jenderny, He Lin, Tracy Garrett, Kenneth D. Tew, Danyelle M. Townsend. Protective effects of a glutathione disulfide mimetic (NOV-002) against cisplatin induced kidney toxicity. Biomedicine & Pharmacotherapy 64 (2010) 73–76.
Скачать - Вайнсон А.А. Об изучении влияния Глутоксима на лучевые реакции кожи стопы мышей. Отчёт лаборатории лучевых методов лечения опухолей Российского онкологического научного центра им. Н.Н. Блохина РАМН. Москва, 2010.
- J.D. Uys , Y. Manevich , L.C. DeVane, L. He, T.E. Garret , C.J. Pazoles , K.D. Tew , D.M. Townsend. Preclinical pharmacokinetic analysis of NOV-002, a glutathione disulfide mimetic. Biomedicine & Pharmacotherapy 2913 (2010).
Скачать - Christina L. Grek, Danyelle M. Townsend, Joachim D. Uys, Christopher J. Pazoles and Kenneth D. Tew. Serpin-A1 and A3 as potential pharmacodynamic biomarkers for NOV-002, a redox modulating anticancer agent. Poster. 2010.
Скачать - Robert R. Bowers, Danyelle M. Townsend, Yefim Manevich, Tracy Garret, Christopher J. Pazoles and Kenneth D. Tew. The redox modulator NOV-002 inhibits proliferation of ovarian tumor cells but increases proliferation of myeloid cells. Poster. 2010.
Скачать - C. Marcela Diaz-Montero, Antonio Perez, Abdel-Aziz Zidan, Christopher J. Pazoles, Alberto J. Montero. Immunomodulatory activity of NOV-002 potentiates the anti-tumor efficacy of cyclophosphamide (CTX) in the CT26 murine colon cancer model. Poster. 2010
Скачать - Н.В.Ведерникова. Влияние дикарбамина и глутоксима на гематологическую токсичность противоопухолевой химиотерапии. Автореферат к.м.н. М. 2009
Скачать - Alberto J. Montero, Osama Naga, Min Xu, Mohamed Salem, Christopher J. Pazoles, C. Marcela D?az-Montero. Nov-002, a cellular redox modulator, enhances the antitumor effect of adoptively transferred t cells in a murine melanoma model. Poster. 2009.
Скачать - Bowers R., Townsend D. M.,. Pazoles C.J et al. NOV-002 suppresses tumor cell growth by modulating redox-sensitive cell signaling. Poster (2009).
Скачать - Danyelle M. Townsend, Yefim Manevich, Lin He, Steven Hutchens, Christopher J. Pazoles and Kenneth D. Tew. Polymorphisms of GST pi: Redox regulation through protein S-glutathionylation. Poster. 2009.
Скачать - Danyelle M. Townsend, Yefim Manevich, Lin He, Steven Hutchens, Tracy Garret, Christopher J. Pazoles and Kenneth D. Tew. In vivo pharmacokinetic and pharmacodynamic behavior of NOV-002, a redox modulating glutathione disulfide mimetic. Poster. 2009.
Скачать - K.Gumireddy, C.Pazoles, E.Vulfson, and Q.Huang. Inhibition of tumor cell invasion and ErbB2/PI3K signaling pathways by the glutathione disulfide-mimetic NOV-002. Poster. 2009
Скачать - Donna M. Easton, Anastasia Nijnik, Matthew L. Mayer and Robert E.W. Hancock. Potential of immunomodulatory host defense peptides as novel anti- infectives. Trends in Biotechnology, Vol.27 No.10.2009
Скачать - Donna M. Easton, Anastasia Nijnik, Matthew L. Mayer and Robert E.W. Hancock. Potential of immunomodulatory host defense peptides as novel anti- infectives. Trends in Biotechnology, Vol.27 No.10. 2009. Перевод.
Скачать - Манихас Г. М., Филатова Е. И., Былинская Е.Н. и соавт. Применение препарата глутоксим при сочетанной лучевой терапии местно-распространенного рака шейки матки. Российский онкологический журнал 2008, 1; 23-28
Скачать - Антушевич А.А. Профилактика и лечение осложнений лучевой терапии рака орофарингеальной области (клинико – экспериментальное исследование). Диссертация … канд.мед.наук. Санкт-Петербург, 2008.
Скачать - Danyelle M. Townsend, Lin He, Steven Hutchens, Tracy E. Garrett Christopher J. Pazoles and Kenneth D. Tew. NOV-002, a Glutathione Disulfide Mimetic, as a Modulator of Cellular Redox Balance. Cancer Res 2008; 68: (8). April 15, 2008
Скачать - Townsend D.M., Pazoles C.J., Kenneth D Tew. NOV-002, a mimetic of glutathione disulfide. Expert Opin. Investig. Drugs. 2008, 17 (7).
Скачать - Danyelle M. Townsend a, Kenneth D. Tew. Pharmacology of a mimetic of glutathione disulfide, NOV-002. Biomedicine & Pharmacotherapy xx (2008) 1-4.
Скачать - Danyelle M. Townsend, Yefim Manevich, Lin He, Steven Hutchens, Christopher J. Pazoles, Kenneth D. Tew. Novel Role for Glutathione S-Tranferase ?: Regulator of Protein SGlutathionylation Following Oxidative and Nitrosative Stress. The Journal of Biological Chemistry. 10. 2008
Скачать - Elda Righi, Victoria Lindstrom, Christine Linton, Pierre Leblanc, Michael Santosuosso, Chris Pazoles, Sandra Orsulic, Rajasekhar Singavarapu, Jeffrey Gelfand1 and Mark C. Poznansky. Positive immunomodulatory effects of NOV NOV-002, 002 , an oxidized glutathione mimetic, in a murine model of ovarian cancer. Poster. 2008.
Скачать - Danyelle M. Townsend, Lin He, Steven Hutchens, Tracy E. VandenBerg, Christopher J. Pazoles and Kenneth D. Tew. NOV-002, a Glutathione Disulfide Mimetic, Is a Pleiotropic Modulator of Cellular Redox Balance. Poster. 2008.
Скачать - C. N. Krasner, M. V. Seiden, R. Penson, M. Roche, D. Kendall, J. Young, U. Matulonis, L. Pereira, S. Berlin. NOV-002 Plus Carboplatin Yields Disease Stability in Platinum-Resistant Ovarian Cancer. Poster. 2008
Скачать - C. Marcela D?az-Montero, Min Xu, Osama Naga, Chris Pazoles, Alberto J. Montero. Down regulation of T Cell Activity by Cyclophosphamide-Induced Myeloid Derived Suppressor Cells is Reversed by the Glutathione Disulfide Mimetic NOV-002. Poster. 2008.
Скачать - C. Marcela Diaz-Montero, N Paphitis1, G Onicescu, N Verma, E Garrett-Mayer, KC Schuhwerk, CJ Pazoles, S Gluck, and AJ Montero. Daily injections of the glutathione disulfide mimetic NOV-002 ameliorates hematologic toxicities from neoadjuvant chemotherapy in breast cancer patients enrolled in the NEO- NOVO trial, and significantly increases circulating dendritic cells. Poster. 2008.
Скачать - Л.В.Минаева. Экспериментальная оценка роли изменений системы глутатиона в реализации побочных цитотоксических эффектов повторного введения циклофосфана. Автореферат. М. 2007, 178 с.
Скачать - А.А.Антушевич, Е.Б.Бурова, К.П.Василенко, В.Г.Антонов, А.Е.Антушевич, Г.Е.Труфанов, А.Г.Климов. Патогенетические основы эффективности Глутоксима при лучевой терапии рака ротоглотки. Клиническая патофизиология. 1-2, 2007. 104-105
Скачать - Danyelle M. Townsend, Kui Lei, Alberto J. Montero, Christopher J. Pazoles and Kenneth D. Tew. NOV-002, a glutathione disulfide mimetic, decreases Cisplatin-induced nephrotoxicity and S-glutathionylates serum proteins in mice. Poster. 2007.
Скачать - Danyelle M. Townsend, Larry K. Keefer, Joseph E. Saavedra, Christopher J. Pazoles and Kenneth D. Tew. Drug Mediated Oxidative or Nitrosative Stress Induces the Unfolded Protein Response. Poster. 2007.
Скачать - Е.И.Филатова, Е.Н.Былинская. Анализ применения препарата Глутоксим при сочетанной лучевой терапии местнораспространенного рака шейки матки XIII Российский национальный конгресс "Человек и Лекарство", Москва 2006 г. Тезисы докладов стр.314
Скачать - К.П.Василенко, Е.Б.Бурова, В.Г.Антонов, Н.Н.Никольский. Окисленный глутатион вызывает активацию рецептора эпидермального фактора роста и мар-киназ ERK1,2 Цитология 2006, том 48, №6, с.500-506
Скачать - Варлан Г.В. Характерные особенности фебрильной нейтропении у больных солидными опухолями. Журнал Ремедиум. 2006, 3.
Скачать - Седакова Л.А., Миндра Н.В., Василенко К.П., Антонов В.Г., Антушевич А.Е., Трещалина Е.М. Предварительные результаты изучения влияния препарата Глутоксим на опухолевый рост и эффективность полихимиотерапии в эксперименте. Материалы первого всероссийского научного форума «Инновационные технологии медицины XXI века». 2005. С.459-461
Скачать - Антонов В.Г., Антушевич А.Е., Бурова Е.Б., Василенко К.П. Возможный механизм модулирующего влияния препарата Глутоксим на регуляторное действие цитокинов. Цитокины и воспаление, 2005, 2; 73.
- Е.Б.Бурова, К.П.Василенко, В.Г.Антонов, Н.Н.Никольский /Трансактивация рецептора эпидермального фактора роста окисленным глутатионом и его фармакологическим аналогом Глутоксим в клетках А431//. 2005,. ДАН, 2005, том 404, №1, с.1-3
Скачать - Giuseppe Filomeni, Katia Aquilano, Patrizia Civitareale, Giuseppe Rotilio, Maria R. Ciriolo Activation of c-Jun-N-terminal kinase is required for apoptosis triggered by glutathione disulfide in neuroblastoma cells * Free Radical Biology & Medicine 39 (2005) 345– 354
Скачать - Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P (2002). "Molecular biology of the cell", the 4th edition. Garland Science, Taylor and Francis group.
- Одинцов С.В., Николаев А.П., Виноградова Н.Н. Опыт использования препаратов Глутоксим у онкологических больных в медицинском центре. Тезисы доклада на VIII Российский национальный конгресс «Человек и лекарство», Москва, 2001.
Скачать - Смирнов А.И., Кожемякин Л.А., Левашев Ю.Н., Орлов С.В. Серусодержащие олигопептиды в лечении больных немелкоклеточным раком легких. Третья ежегодная российская онкологическая конференция. Санкт-Петербург, 1999, 140-141.
Скачать